Carica formale = elettroni di valenza dell’atomo neutro – ½ numero di elettroni condivisi – il numero di elettroni dei doppietti solitari
Ad esempio nella molecola CH2O2 il carbonio forma 4 legami: uno con l'idrogeno, uno con un atomo di ossigeno e un doppio legame (che vale quanto due singoli legami) con un altro atomo di ossigeno.
Dato che per ogni legame sono impiegati 2 elettroni ci sono in tutto 8 elettroni condivisi. Di questi 8 elettroni, 4 sono gli elettroni condivisi dal carbonio, e siccome il carbonio ha 4 elettroni esterni ci sono 0 doppietti solitari.
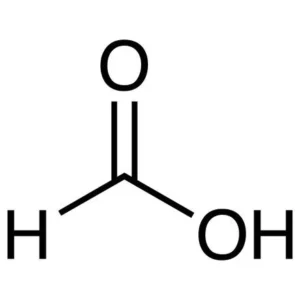
Quindi, usando la formula di prima, troviamo che la carica formale del carbonio è 4 - 4 - 0 = 0. Siccome la carica è 0 vuol dire che in questa molecola il carbonio è neutro.
